適應對象:
根據中華人民共和國衛生部部長簽署的2011年第79號令,《藥品生產質量管理規范(2010年修訂)》(下稱新版GMP)已于2010年10月19日經衛生部部務會議審議通過,自2011年3月1日起施行。
中國新版GMP與98版相比從管理和技術要求上有相當大的進步。特別是對無菌制劑和原料藥的生產方面提出了很高的要求,新版GMP以歐盟GMP為基礎,考慮到國內差距,以WHO2003版為底線。
新版GMP認證有兩個時間節點:藥品生產企業血液制品、疫苗、注射劑等無菌藥品的生產,應在2013年12月31日前達到新版藥品GMP要求;其他類別藥品的生產均應在2015年12月31日前達到新版藥品GMP要求。未達到新版藥品GMP要求的企業(車間),在上述規定期限后不得繼續生產藥品。
針對藥品GMP項目提供以下服務:
1.廠區規劃設計;生產工藝、化驗室、倉儲布局設計,或對企業現有廠區、相關車間、化驗室、倉儲的規劃合理性進行咨詢提出整改意見和整改方案。
2.協助企業進行相關生產設備、檢驗儀器選型與完善;凈化廠房施工。
3.GMP文件管理體系的建立與指導企業實施。
4.對企業相關人員有針對性的進行GMP相關培訓。
5.協助企業完成相關廠房設施、生產關鍵設備、設備清洗、生產工藝等驗證工作。
6.協助企業進行自檢并進行模擬檢查。
7.協助企業認證申報資料制作、遞交。
8.協助企業迎檢準備工作與GMP認證現場檢查及現場檢查通過后的整改工作。
9.相關政策法規、最新政策動態咨詢; GMP復檢審計咨詢等。
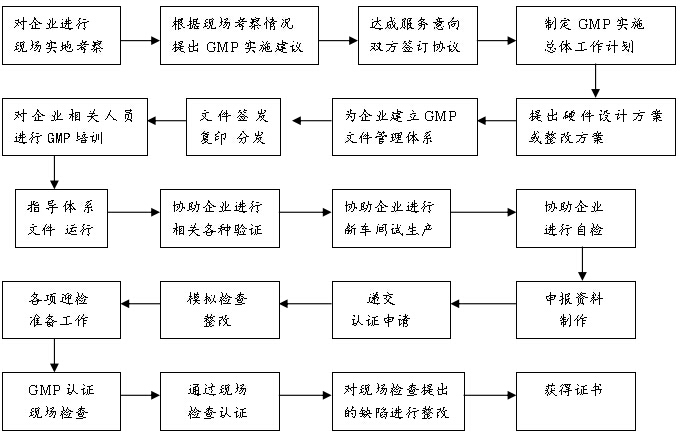
藥品GMP認證咨詢工作流程如下: